
Avaliação da eficácia da adição de prebiótico na modulação da resposta imune de cadelas no pós-parto
Nathalia de Oliveira¹
Ana Carolina Porto²
1Graduanda do Curso de Medicina Veterinária - UNISO
2 Univittá Saúde Animal
3 Docente do curso de Medicina Veterinária - UNISO
1.INTRODUÇÃO
Durante a gestação ocorre importantes alterações no sistema imunológico materno para que este seja tolerante aos antígenos paternos (SMYTH; DEGLI-ESPOSTI, 2005). A imunossupressão é uma característica evidenciada no final da gestação, quandoos animais normalmente apresentam deficiências na reatividade imune, mediada por células contra antígenos não fetais (TIZARD, 1988).
O puerpério é a fase imediatamente após o parto onde ocorre a involução uterina da cadela e a preparação do útero para uma nova gestação. Esse desenvolvimento pode ser dividido em duas fases: de livramento e puerpério (GRUNERT; BIRGEL, 1989) e leva cerca de 12 semanas para se completar. Após o parto, a diminuição da ingestão de alimento e o aumento do consumo energético ocasionado pelo processo de lactação, levam a um quadro de imunossupressão sistêmica, o que aumenta a suscetibilidade das fêmeas à ocorrência de infecções uterinas e outras doenças puerperais (LEWIS, 1997). A susceptibilidade do útero e sua resistência dependem da atividade dos neutrófilos, da motilidade e do tônus uterino, da eliminação de microrganismos e da presença de imunoglobulinas. Tais fatores estão presentes com maior intensidade na fase estrogênica, já que o estrógeno promove vasodilatação, maior afluxo sanguíneo e assim maior presença de imunoglobulinas e maior contratilidade uterina. Já em fase progesterônica, como ocorre no diestro e na gestação, a resistência às infecções é muito reduzida pela diminuição da contratilidade uterina e da atividade leucocitária, pelo menor afluxo sanguíneo e pela imunossupressão durante a gestação (NASCIMENTO; SANTOS, 1997).
De acordo com estudos de Hansen (2013) com vacas leiteiras, alguns fatores de risco podem explicar variações individuais no desenvolvimento de doenças uterinas após o parto, como por exemplo, exposição a um desafio bacteriano superior a idoneidade do sistema imunológico, adaptações ocorridas para manter concepto durante a gestação podendo persistir e favorecer a presença de micro-organismos invasores ou falhas no mecanismo de defesa imune local e/ou sistêmica relacionados com a limpeza do ambiente uterino. É citado também o efeito imunossupressor da progesterona e a presença de células do sistema imunológico que inibem a resposta inflamatória. Em várias espécies, logo após o parto, é comum ocorrer certo grau de infecção uterina (NASCIMENTO; SANTOS,1997). Em sua maioria, as lesões inflamatórias do útero não-gestante têm origem infecciosa e resultam de uma infecção ascendente por microrganismos que normalmente habitam o trato genital inferior ou por agentes infecciosos introduzidos na cavidade uterina durante o acasalamento, inseminação artificial ou no pós-parto (JONES et al, 2000).
O trato reprodutor das cadelas geralmente é acometido por diversas afecções após o parto, dentre elas a vaginite aguda e crônicas sendo frequentes infecções mistas (TEIXEIRA, 1993); endometrite subclínica; endometrite crônica podendo acumular pus com o fechamento da cérvix (OLSON,1984;FAYER-HOSKEN, 1994; COKCROFT,1995); complexo hiperplasia cística endometrial-piometrite; metrite aguda ou puerperal que ocorre após o parto devido a distocia, retenção de placenta e/ou manipulação obstétrica (ROSZEL, 1977; NELSON; FELDMAN, 1986);subinvolução dos locais placentários levando a quadros de piometrite (BURKE, 1977; AL-BASSAM,1982) e cistos de corpo lúteo e folículos luteinizados que tendem a aumentar a produção de progesterona levando a quadros de hiperplasia cística endometrial e piometrite (YOUNGQUIST, 1986).
O exame ginecológico completo nas cadelas é de extrema importância para o diagnóstico de patologias da reprodução, fazendo necessário a utilização de exames complementares para a conclusão correta da etiologia, como por exemplo a colpocitologia (GRANDI; BESERRA; COSTA, 2014)e hemograma .A colpocitologia permite a associação dos tipos celulares encontrados com achados clínicos, como o caso da presença de leucócitos não somente no diestro de cadelas sadias, mas também nas outras fases, como indicativo de infecções do trato reprodutivo(VICENTE; APPARICIO, 2015). Através do hemograma são obtidos valores quantitativos de leucócitos, o que pode auxiliar no diagnóstico de algumas doenças de caráter sistêmico (KERR, 2003).
Os prebióticos são componentes alimentares não digeríveis que afetam beneficamente o hospedeiro, por estimular a proliferação ou atividade de populações de bactérias desejáveis no cólon, inibindo a multiplicação de patógenos, além de estimular a resposta imune, levando a benefícios adicionais ao organismo (ROBERFROID, 2002). Os dois principais polissacarídeos constituintes da parede celular das leveduras (β-D-glucanos e α-D-manano) têm sido recentemente reconhecidos como prebioticos por serem capazes de promover modulação do sistema imune de diversos organismos vivos, desde insetos a humanos, mediante interações específicas com diferentes células imunocompetentes (GARCIA, 2008).
Os mananoligossacarídeos (MOS) são obtidos a partir da parede celular de leveduras (Saccharomyces cerevisiae), e algas marinhas calcárias (Lithothamnium calcareum) a qual consiste de uma estrutura complexa de manose fosforilada, glucose e proteína. Em estudos de Middelbos et al. (2007), observou-se redução significativa na concentração de E. coli em cães suplementados com parede de levedura e Swanson et al. (2002b), encontraram aumento de Lactobacilus no IG de cães adultos. De acordo com Gouveia et al. (2006) constatou-se a efetividade do MOS em cães com idade entre 2 e 6 meses com quadros de gastroenterite, havendo a eliminação da Escherichia coli patogênica em 85,71% dos animais, enquanto que, no grupo sem o MOS, apenas 25% não apresentaram o microrganismo. Neste estudo, o MOS foi efetivo no controle da E. coli patogênica, sendo indicado como tratamento adjuvante nas gastroenterites. Os MOS são capazes de induzir a ativação de macrófagos, saturando os receptores de manose das glicoproteínas da superfície celular, que se projetam da superfície da membrana celular dos macrófagos. Uma vez que três ou mais lugares tenham sido saturados, inicia-se uma reação em cadeia com a instalação de uma resposta imunológica adquirida (MACARI; MAIORKA, 2000). A suplementação diária de 2 g de MOS e 2 g de FOS, conjuntamente na dieta, apresentou os melhores resultados em relação à saúde dos cães, com aumento da resposta imune local (44% a mais de IgA) e diminuição de compostos putrefativos (GOUVEIA et al., 2006).
2. OBJETIVOS
2.1 Objetivos gerais da pesquisa
Avaliar a eficácia da adição de prebiótico à base de MOS, na dieta de cadelas gestantes na modulação da resposta imune após o parto.
2.2 Objetivos
específicos
Treinar o discente em práticas relacionadas à reprodução canina
Treinar o discente em práticas de patologia clínica, através da realização e
interpretação de exames laboratoriais;
Avaliar a influência da suplementação com prebióticos nos parâmetros hematológicos de cadelas no pós parto;
Avaliar a influência da suplementação com prebióticos no perfil celular vaginal de cadelas no pós parto;
Avaliar a influência da suplementação com prebióticos na produção de anticorpos específicos por cadelas no pós parto.
3. DELINEAMENTO DE ESTUDO
Trata-se de estudo experimental com animais.
Os experimentos foram realizados segundo as Normas e Éticas estabelecidas para experimentação com animais conscientes, recomendadas pela Associação Internacional para o Estudo da Dor (IASP International Association for the Study of Pain), com aprovação do CEUA (comitê de ética do uso de animais), nº: A019/CEP/2009
4. MÉTODOS
4.1 Animais:
Foram utilizadas oito fêmeas gestantes de raças distintas, escolhidas aleatoriamente, sendo: Yorkshire, Shih-tzu, Maltês, Pastor Alemão e Border Collie. A alimentação das fêmeas de ambos os grupos foi baseada em ração comercial e água a vontade durante todo o estudo.
4.2 Grupos experimentais:
Os animais foram divididos em dois grupos: GT – grupo teste (com suplementação) e GC – grupo controle (sem suplementação). Todos os animais foram identificados pelos próprios nomes nos tubos das amostras de sangue, eppendorffs e nas laminas de citologia de acordo com as datas de coletas.
4.3 Suplementação:
A suplementação das fêmeas pertencentes ao GT foi iniciada no 30º dia de gestação contado a partir da data da última cobertura. Se tratando de raças distintas com peso inferior a 10 kg, a dose estipulada foi de 1,5g por dia, até o dia do parto. O produto fornecido em pó, foi pesado e distribuído em recipientes de vidro, identificados e numerados para cada fêmea do grupo (Fig 1 e 2)

Fig.1: Recipientes de vidro enumerados contendo o suplemento em pó.

Fig. 2 Recipiente de vidro contendo 1,5g do suplemento em pó.
4.4 Imunização:
Para avaliação da resposta imune humoral específica foi realizada a imunização com KHL (Keyhole limpet hemocyanin – KLH) das cadelas gestantes. A imunização ocorreu 30 e 23 dias antes da data prevista de parto pela via intramuscular, após avaliação ultrassonográfica dos fetos (Fig 3).

Fig. 3 - Ultrassonografia realizada em cadela prenhe com cerca de 35 dias de gestação.
Se tratando de raças distintas, fêmeas com peso < 10 kg foram imunizadas com duas doses de 0,15mg de KHL diluída em água deionizada estéril e fêmeas com peso >10kg foram imunizadas com duas doses 0,25mg, (Fig 4).

Fig. 4 - Imunização com KHL em cadela prenhe no 45ª dia de gestação.
4.5 Coleta de Sangue:
Amostras de sangue foram coletadas 15 dias antes da data prevista do parto, até 48 horas após o parto e nos dias D8, D15, D30, D45, D60, D90 e D120 após a ocorrência do parto. A punção foi realizada pela veia cefálica ou jugular, utilizando seringas descartáveis de 5 ml para possibilitar a retirada de 4 ml de sangue total; e agulhas hipodérmicas (13x0,38mm / Pol. 27,5G 1/2") e armazenados em tubos contendo anticoagulantes (EDTA – pó ou líquido) para a realização de hemograma e em tubos sem anticoagulante para realização do ensaio imunológico (Fig 5).
Em todas as imunizações realizadas foram coletadas entre 0,5 - 1 mL de amostras de sangue, sendo armazenadas em tubo gel (sem anticoagulante) e refrigeradas em caixa de isopor de transporte contendo gelo. Nas primeiras 48h após o parto foram coletados entre 2 – 4mL de amostras de sangue, contando como D1 (dia 1). As amostras foram armazenadas em tubo gel e tubo com anticoagulante (EDTA), também refrigeradas em caixa de isopor de transporte até a chegada ao laboratório. Os esfregaços sanguíneos foram corados com Panótico para realização de diferenciação de leucócitos no microscópio óptico.
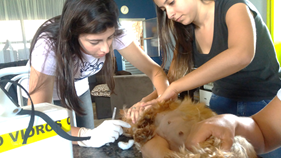
Fig. 5 – Coleta de amostra sanguínea através da punção da veia jugular esquerda com auxílio de voluntaria e proprietária na contenção.
Todas as amostras contidas em tubo gel foram centrifugadas a 3000 RPM por 10 minutos para posterior retirada do soro. Este, foi colocado em eppendorff devidamente identificado e armazenado em congelador para posterior análise de anticorpos (Fig 6).
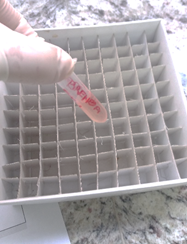
Fig. 6 – Amostra identificada e armazenada em eppendorff contendo soro sanguíneo.
4.6 Coleta de amostras para citologia vaginal:
Nas primeiras 48h após o parto também foram coletadas amostras para citologia vaginal com o auxílio de 1 ou 2 swab estéreis, que gentilmente foram introduzidos na comissura dorsal da vagina em um ângulo de 45º e empurrados em direção ao arco esquiático com movimentos de rotação em sentido horário ou anti-horário (GRANDI; BESERRA; COSTA, 2014), em seguida sendo transpassadas em laminas (coradas com Panótico) para posterior análise em microscópio óptico. Da mesma forma que a coleta hematológica, a partir do D1 (dia 1) as coletas se tornaram sucessivas aumentando os intervalos entre elas, sendo: D8, D15, D30, D45, D60, D90 e D120 (Fig. 7). As amostras foram devidamente identificadas e armazenadas em porta laminas.
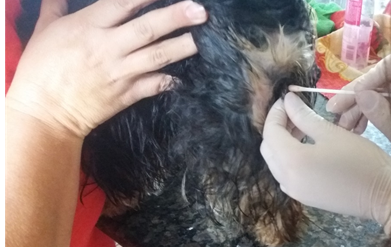
Fig. 7 – Coleta de amostra citológica vaginal
4.7 Hemogramas e hematócritos:
Amostras contidas no tubo de EDTA foram homogeneizadas e processadas no contador automático de células da marca Brasmed (Fig 8), além de centrifugadas em micro capilares por 5 minutos a 11.500 RPM para leitura dos hematócritos.
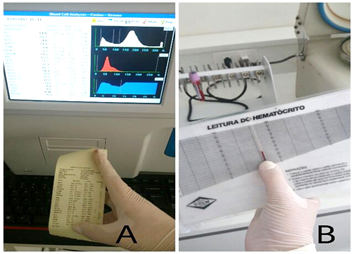
Fig. 8 – A: Exame realizado no contador automático de células da marca Brasmed. B: Leitura de hematócrito após entrifugação
5. RESULTADOS
5.1 Suplementação:
A suplementação com MOS a base de pó misturado à ração seca não foi bem aceita pelas fêmeas gestantes. Houve aceitação somente quando adicionado a um alimento úmido ou a água propriamente dita, formando uma espécie de papinha (Fig 9 e 10).

Fig. 9 - Preparação da proprietária do suplemento em forma de papinha.

Fig. 10 - Aceitação da fêmea pela papinha.
Observou-se também que uma das 5 fêmeas testadas, apresentou reação a suplementação, com sintomatologia clínica de vomito e diarreia, sendo necessário a retirada desta do estudo.
Dentre as 4 fêmeas restantes pertencentes ao grupo teste, 2 obtiveram aumento de peso (cerca de 100 gramas a mais) na sua ninhada se comparado com gestações anteriores, de acordo com relato do proprietário (Fig 11).

Fig. 11 – Filhote sendo pesado após relato de aumento de peso corporal da ninhada.
5.2 Análises hematológicas:
Foi possível observar anemia discreta em grande parte das fêmeas de ambos os grupos, com variações no hematócrito e na porcentagem de hemoglobina total, mas com valores ainda assim abaixo da referência, sendo que a partir do D30, os valores da série vermelha se normalizaram (Tabela 1). Entretanto, não houve variação leucocitária significativa nas fêmeas de ambos os grupos, cuja média dos valores leucocitários totais se encontraram dentro dos valores normais de referência (Tabela 2). Nos esfregaços notou-se a presença de corpúsculos de Howel-Jully - fragmentos nucleares arredondados (micronúcleos) (KIRSCH-VOLDERS, 2003) - nas laminas de algumas fêmeas nas primeiras semanas após o parto.
5.3 Análises citológicas:
As análises citológicas foram baseadas segundo estudos de Allen (1985) e Santos (2006), quantificando as estruturas observadas em nulas/quase nulas (-), raras (+), frequentes (++), abundantes (+++) e incontáveis (++++). Pode-se observar presença de bactérias em todas as fêmeas em todos os momentos experimentais, exceto na fêmea 1 do grupo teste no primeiro dia coletado. Observou-se que as fêmeas do grupo controle mostraram maior presença de bactérias em todos os momentos analisados (Tabela 3 e 4).



Possui graduação em Medicina Veterinária pela UNIP (2002), mestrado em Biologia Celular, Molecular e Imunologia pela FMRP/USP (2005), doutorado em Clínica Médica pela FMVZ/USP (2010), Pós Doutoranda do Departamento de Reprodução Animal pela FMVZ/USP (2015) e MBA em Liderança e Gestão de Equipes pela UNISO (2018). Atualmente coordena o curso de Medicina Veterinária da Universidade de Sorocaba e se dedica a estudar os desafios da educação no século XXI e a modulação da resposta imune pelo uso da ozonioterapia. Tem experiência nas áreas de imunologia clínica, biologia celular e molecular, neonatologia e reprodução de eqüinos.
Mais artigos deste autorHá quem acredite que os animais não têm a mesma sensibilidade à dor dos seres humanos. A verdade é que nós nos expressamos muito melhor e demonstramos o mínimo desconforto, enquanto os animais podem mostrar uma postura de dor quase imperceptível aos olhos de uma pessoa destreinada.
Se uma patologia causada por bactéria já assusta, imagine quando esse microrganismo ganha um superlativo: “superbactéria”. Pois saiba que as superbactérias realmente existem e podem acometer tanto humanos quanto pets.




Gostou deste post? Deixe seu comentário